热门话题
#
Bonk 生态迷因币展现强韧势头
#
有消息称 Pump.fun 计划 40 亿估值发币,引发市场猜测
#
Solana 新代币发射平台 Boop.Fun 风头正劲
我与GPT-5的“第37步”时刻
今天,我分享我测试GPT-5思维和专业模型时最显著的经历之一。
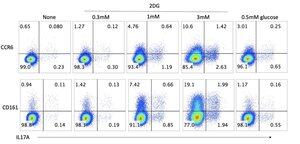
在我们的实验室,大约两年前,我们进行了一系列前沿的免疫学实验,旨在操控T细胞的能量代谢,这些免疫细胞有能力影响癌症免疫疗法、慢性疾病和自身免疫。
我们获得了令人着迷的结果,但有一个发现仍然无法解释。几周的工作让我们得到了部分解释,但完整的图景依然难以捉摸。
从这些实验中,我上传了下面未发表的图形,并请GPT-5 Pro进行解释。
GPT-5:
✅ 正确识别了我们从图形中得出的关键发现(尽管其他模型也能做到这一点)。
✅ 提出了我们后来进行的确切实验,这个实验的设计花费了我们几周的时间(o3-pro也曾建议过这一点)。
✅ 最令人瞩目的是,提出了一个机制,最终解释了这些结果!
对我来说,这相当于AlphaGo的传奇第37步。
它显示出AI已经成为顶尖专家和真正的科学合作者,能够进行真正的洞察。
虽然这些结果尚未发表,但我分享一些GPT-5的输出,作为其他科学家的示例,并展示这将如何显著加速科学进步!我还将撰写并提交这篇论文,并需要在其中承认GPT-5的贡献!
—
来自GPT-5
数据所示:
• 在第一次激活时,短暂的2DG暴露会留下持久的偏移,朝向CCR6+和CD161+表型,伴随IL-17A能力的增加,这种能力在两周后重新激活时仍然明显。
...
热门
排行
收藏













