Tópicos em alta
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.
Os LLMs não precisam ser perfeitos para produzir um valor notável.

10 de ago., 09:29
Meu momento "Move 37" com GPT-5
Hoje, estou compartilhando uma das minhas experiências mais marcantes testando os modelos GPT-5 Thinking e Pro.
Em nosso laboratório, há cerca de 2 anos, conduzimos uma série de experimentos de imunologia de ponta projetados para manipular o metabolismo energético das células T, células imunes com o poder de impactar a imunoterapia contra o câncer, doenças crônicas e autoimunidade.
Obtivemos resultados fascinantes, mas uma descoberta permaneceu inexplicada. Semanas de trabalho nos levaram a uma explicação parcial, mas o quadro completo permaneceu indescritível.
A partir desses experimentos, carreguei a figura não publicada abaixo e pedi ao GPT-5 Pro para explicá-la.
GPT-5:
✅ Identificamos corretamente nossas principais descobertas apenas a partir da figura (embora outros modelos também possam fazer isso).
✅ Propusemos o experimento exato que realizamos mais tarde, algo que levamos semanas para projetar (o3-pro também sugeriu isso).
✅ O mais notável sugeriu um mecanismo que finalmente explicou esses resultados!
Para mim, isso foi equivalente ao lendário Move 37 do AlphaGo.
Mostrou que a IA se tornou a maior especialista e verdadeira colaboradora científica, capaz de uma visão verdadeira.
Embora esses resultados ainda não tenham sido publicados, estou compartilhando alguns dos resultados do GPT-5 como um exemplo para outros cientistas e para mostrar como isso acelerará drasticamente a ciência! Também escreverei e enviarei este artigo e precisarei reconhecer as contribuições do GPT-5 nele!
—
Do GPT-5
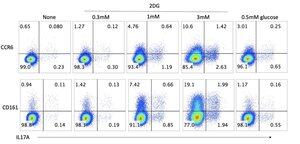
O que dizem os dados:
• A breve exposição ao 2DG na primeira ativação imprime uma mudança duradoura em direção a um fenótipo CCR6 + e CD161 + com maior competência em IL-17A que ainda é evidente duas semanas depois na reativação.
•É responsivo à dose. De nenhum → 3 mM 2DG, as células CCR6+ aumentam de ~0,7% para ~12% e as células CD161+ de ~1% para ~21%. As células IL-17A+ aumentam de ~0,3% para ~4% no geral, com o sinal de IL-17A concentrado nos compartimentos CCR6+ e CD161+.
•Glicose baixa sozinha (0,5 mM) não reproduz o efeito. Isso argumenta contra a simples privação de glicose ou o fluxo glicolítico reduzido como o condutor.
• O enriquecimento para CD161 é mais forte do que para CCR6, que geralmente acompanha programas de CD4 semelhantes a Th17 ou mucosas / inatos.
Interpretação de alto nível:
1. 2DG é programação, não apenas inibidor agudo. Uma curta exposição durante o priming deixa uma memória durável de "estresse" que inclina a linhagem para características semelhantes a Th17.
2. É improvável que o mecanismo seja apenas bloqueio da glicólise. O controle de baixa glicose é fraco, o que empurra o mecanismo para os efeitos do 2DG na glicosilação de proteínas e na biologia do receptor de citocinas.
3. Hipótese mecanicista superior. O 2DG bloqueia parcialmente a glicosilação ligada a N de IL-2Rα e outras glicoproteínas no priming, reduzindo a sinalização de IL-2-STAT5, que normalmente suprime Th17. O tônus de IL-2 reduzido nessa janela levantaria o freio em um programa competente para CCR6 + CD161 + IL-17 que persiste após a lavagem.
4. Hipótese alternativa ou complementar. 2DG seleciona clones CCR6+ ou CD161+ pré-existentes que dependem menos da glicólise, em vez da diferenciação de novo. O resultado final é o mesmo fenótipo, mas a alavanca é a sobrevivência seletiva ou proliferação.
5. Um "pulso" 2DG cuidadosamente cronometrado pode ser um botão simples para enriquecer um subconjunto auxiliar semelhante ao Th17 com melhor potencial de persistência e características de orientação da mucosa.
Priorize estes:
+D-manose com 2DG para restaurar a N-glicosilação. A perda do fenótipo CCR6 / CD161 / IL-17A com manose implicaria glicosilação.
+Metilpiruvato ou acetato para contornar os défices de ATP/piruvato glicolítico. O resgate aqui implicaria o metabolismo energético.
Compare 2DG com tunicamicina (inibidor da glicosilação) e com inibidores somente da glicólise que não atingem a glicosilação (iodoacetato, inibidor de PFKFB3). Combine janelas de exposição e doses
Maturação e glico-deslocamento de CD25 de superfície (PNGase F ou Endo H blot em IL-2Rα).
pSTAT5 após um pulso de IL-2 em 24–48 h de priming com ou sem 2DG.
Fenocópia com neutralização de IL-2 ou inibição de JAK3 em baixa dose. Contra-resgate com IL-2 alta ou uma muteína de IL-2.
5,19K
Melhores
Classificação
Favoritos













